Молекулы белка, являющиеся одними из основных компонентов живых организмов, обладают сложной и уникальной структурой. Однако, перед тем как приобрести свою трехмерную конфигурацию, молекула белка должна пройти через формирование четвертичной структуры.
Четвертичная структура представляет собой взаимное расположение и взаимодействие нескольких полипептидных цепей, которые связываются друг с другом и образуют многоци-000лен, или комплекс. Высокая степень организации и взаимодействия молекул в четвертичной структуре определяется не только последовательностью аминокислот, но и физико-химическими свойствами самих цепей. От правильно сформированной четвертичной структуры зависит функционирование белка в клетке.
Для формирования четвертичной структуры молекулы белка, полипептидные цепи связываются друг с другом при помощи различных химических взаимодействий. Наиболее распространенным типом взаимодействия является водородная связь, которая обеспечивает стабильность комплекса. Кроме того, взаимодействие между аминокислотами может осуществляться за счет сил ван-дер-Ваальса, ионных связей и гидрофобных взаимодействий.
Синтез и последовательность аминокислот
Аминокислоты — это органические соединения, которые являются строительными блоками белка. Всего существует около 20 различных аминокислот, и их последовательность определяет структуру и функцию конкретного белка.
Синтез аминокислот происходит в клеточных органеллах, называемых рибосомами. На рибосоме происходит синтез белка по инструкции, закодированной в ДНК. Этот процесс включает транскрипцию ДНК в РНК и последующую трансляцию РНК в последовательность аминокислот.
Последовательность аминокислот в белке имеет важное значение, так как она определяет его форму, функцию и взаимодействие с другими молекулами. Даже незначительные изменения в последовательности аминокислот могут привести к изменениям в структуре и функциональности белка, что может иметь серьезные последствия для организма.
Транскрипция и трансляция
Процесс синтеза аминокислот начинается с транскрипции ДНК. Во время транскрипции молекула РНК полимеразы связывается с определенным участком ДНК, разделяет две цепочки двуцепочечной ДНК и копирует одну из них в молекулу мРНК.
Полученная молекула мРНК затем перемещается в рибосому, где происходит трансляция. Во время трансляции молекула мРНК считывается рибосомой, и на основе последовательности нуклеотидов в молекуле мРНК синтезируется цепочка аминокислот.
Значение последовательности аминокислот
Последовательность аминокислот в белке придает ему свойства, определяющие его функциональность. Каждая аминокислота имеет свои химические свойства и может взаимодействовать с другими аминокислотами, водой и другими молекулами.
Важно отметить, что изменения в последовательности аминокислот могут приводить к изменениям в структуре и функциональности белка. Например, изменения в гене, кодирующем последовательность аминокислот, могут вызывать генетические заболевания или повлиять на способность организма выполнять определенные функции.
| Аминокислота | Кодон | Свойства |
|---|---|---|
| Глицин | Gly | Гидрофильная, гидрофобная или поларная |
| Аланин | Ala | Гидрофобная |
| Лейцин | Leu | Гидрофобная |
| Фенилаланин | Phe | Гидрофобная |
Таким образом, синтез и последовательность аминокислот являются важными аспектами формирования четвертичной структуры белка и определяют его функцию и свойства.
Взаимодействие между белковыми подцепями
Формирование четвертичной структуры молекулы белка происходит благодаря взаимодействию между его белковыми подцепями. Белковые подцепи представляют собой отдельные цепочки аминокислот, которые соединяются вместе и образуют окончательную структуру белка.
Взаимодействие между белковыми подцепями осуществляется посредством различных типов связей и взаимодействий:
- Гидрофобные взаимодействия
Гидрофобные аминокислоты, которые не любят контакт с водой, собираются внутри молекулы белка, образуя гидрофобные кластеры. Эти кластеры позволяют белковым подцепям удерживаться вместе, создавая стабильность в четвертичной структуре. - Электростатические взаимодействия
Заряженные аминокислоты могут притягиваться или отталкиваться друг от друга, создавая электростатические взаимодействия. Эти взаимодействия могут участвовать в формировании прочных связей между белковыми подцепями. - Водородные связи
Водородные связи образуются между атомами водорода и электронными парами в атомах азота, кислорода или фтора. Водородные связи могут содействовать стабилизации четвертичной структуры белка, удерживая белковые подцепи вместе. - Взаимодействия водородных связей между белками
Молекулы белков могут взаимодействовать между собой посредством водородных связей. Такие взаимодействия способны удерживать разные белковые подцепи вместе и формировать сложные структуры мульти-протеинов.
Взаимодействие между белковыми подцепями является ключевым процессом формирования четвертичной структуры молекулы белка и определяет ее функциональность и стабильность.
Образование петель и спиралей
Аминоательные петли
Аминоательные петли образуются за счет связей между аминокислотными остатками в полипептидной цепи. Эти петли могут быть различной длины и формы, и их структура зависит от взаимодействия различных атомов и функциональных групп. Аминоательные петли могут быть разнообразной структуры и выполнять различные функции внутри белка, например, обеспечивать связывание субстратов или металлов.
Гельминтные спирали
Гельминтные спирали образуются из участков полипептидной цепи, которые сворачиваются вокруг оси, образуя спиральную структуру. Эти спирали могут быть простыми или сложными, и их форма определяется последовательностью аминокислотных остатков. Гельминтные спирали могут быть стабильными и служат для структурной поддержки и укрепления белка.
Образование петель и спиралей является одним из важных процессов, определяющих структуру и функцию белка. Правильное формирование и взаимодействие этих структур позволяет белкам выполнять свои функции эффективно и специфично.
Влияние физических условий на структуру белка
Формирование четвертичной структуры молекулы белка, которая представляет собой комплексное взаимодействие различных подъединиц, может быть зависимо от физических условий, в которых находится белок. Физические условия, такие как температура, pH-уровень, растворитель и т.д., могут существенно влиять на структуру белка и его функциональные свойства.
Температура
Изменение температуры может привести к нарушению структуры белка. Возвышенная температура может вызвать денатурацию белка, то есть разрушение его третичной и вторичной структуры. При низкой температуре, напротив, некоторые белки могут образовывать агрегаты или влагалища, что также может привести к изменению их функциональности.
pH-уровень
Помимо температуры, pH-уровень окружающей среды может также оказывать влияние на структуру белка. Изменение pH может влиять на заряды аминокислот внутри белка, что может вызывать изменения в его пространственной конфигурации. Буферные системы могут использоваться для поддержания оптимального pH, что помогает сохранять стабильность белковой структуры.
Роль интра- и интермолекулярных сил
Интрамолекулярные силы
Интрамолекулярные силы действуют внутри молекулы белка и обусловлены взаимодействием атомов и групп функциональных групп внутри белковой цепи. Они включают в себя водородные связи, ионно-дипольные взаимодействия, дисульфидные мостики и другие взаимодействия на уровне атомов.
Водородные связи являются одним из наиболее сильных интрамолекулярных сил и играют важную роль в формировании пространственной структуры белка. Они возникают между атомами водорода и электроотрицательными атомами, например, кислородом или азотом.
Ионно-дипольные взаимодействия возникают между ионами и диполями внутри молекулы белка. Они являются слабыми, но могут способствовать укреплению структуры белка.
Дисульфидные мостики возникают при окислении специфических остатков цистеина в белке. Они играют решающую роль в формировании третичной и четвертичной структуры, устойчивости белка к термическому и химическому воздействию.
Интермолекулярные силы
Интермолекулярные силы связаны с взаимодействием молекул белка друг с другом. Они включают в себя ван-дер-ваальсовы взаимодействия, гидрофобное взаимодействие и электростатическое взаимодействие.
Ван-дер-ваальсовы взаимодействия возникают между неполярными молекулами белка и обусловлены временным электрическим поляризацией атомов. Они слабые, но могут способствовать сближению и укреплению структуры белка.
Гидрофобное взаимодействие возникает из-за взаимодействия гидрофобных групп аминокислот с водой. Оно играет важную роль в формировании внутренней структуры белка и создании гидрофобного сердцевинного узла.
Электростатическое взаимодействие возникает между заряженными частями молекулы белка и зависит от распределения электрического заряда. Оно может существенно влиять на структуру белка и его взаимодействие с другими молекулами.
Интра- и интермолекулярные силы играют существенную роль в формировании четвертичной структуры молекулы белка, обеспечивая её устойчивость, функциональность и способность взаимодействовать с другими молекулами.
Взаимодействие белка с другими молекулами
Взаимодействие белка с другими белками
Белки могут образовывать комплексы с другими белками, что позволяет им работать совместно для выполнения определенных функций. Такие комплексы могут образовываться путем физического взаимодействия или через специальные белковые связывающие домены.
Примером такого взаимодействия является образование ферментативных комплексов, где несколько белков работают вместе для катализа химических реакций. Также белки могут взаимодействовать с белками-рецепторами на поверхности клеток, инициируя сигнальные каскады и регулируя различные процессы в клетке.
Взаимодействие белка с другими молекулами
Белки могут взаимодействовать с нуклеиновыми кислотами, углеводами и липидами, что также является важным для их функционирования. Например, некоторые белки способны связываться с ДНК или РНК, регулируя транскрипцию генов.
Белки также могут взаимодействовать с углеводами и липидами, образуя комплексы, которые играют роль в транспорте и распределении различных молекул в организме. Некоторые белки способны связываться с липидными мембранами и участвовать в различных процессах, связанных с мембраной, таких как транспорт через мембрану или сигнальные пути.
Взаимодействие белка с другими молекулами является неотъемлемой частью его функционирования и позволяет ему выполнять различные биологические задачи в организме.
Роль кислотно-основного равновесия
Кислотно-основное равновесие играет важную роль в формировании четвертичной структуры молекулы белка. Кислоты и основания могут взаимодействовать с аминокислотами, влияя на их заряд и структуру.
Аминокислоты и их заряды
Аминокислоты – основные строительные блоки белка. У них есть специфическая группировка атомов, которая может проявлять кислотные или основные свойства. В зависимости от pH среды, аминокислоты могут иметь разное число протонов и, следовательно, разные заряды.
ПКА и точка изоэлектрического pH
Для каждой аминокислоты существует определенное значение рН, называемое постоянной диссоциации или пКА. Оно определяет, насколько сильно аминокислота может отдавать или принимать протоны. Также существует точка изоэлектрического pH, при котором аминокислота не имеет заряда и находится в состоянии максимальной стабильности.
Влияние кислотно-основного равновесия на формирование четвертичной структуры молекулы белка заключается в том, что изменение pH среды может привести к изменению заряда аминокислот и, следовательно, к изменению их взаимодействий и структуры белка. Это может быть важно для раскрытия активных центров белка или изменения его конформации.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции играют важную роль в формировании четвертичной структуры молекулы белка. В биохимических процессах эти реакции обеспечивают передачу электронов между различными молекулами, что способствует изменению их окислительного состояния.
В результате окислительно-восстановительных реакций происходит образование связей дисульфидных мостиков между аминокислотными остатками, что способствует укреплению и стабилизации четвертичной структуры белка.
Окислительно-восстановительные реакции также играют важную роль в обеспечении биологических функций белка. Например, в оксидативном фосфорилировании происходит передача электронов в цепь транспорта электронов, что способствует синтезу АТФ — основного источника энергии в клетках.
Таким образом, окислительно-восстановительные реакции не только обеспечивают формирование четвертичной структуры молекулы белка, но и играют важную роль в обеспечении его биологических функций.
Влияние металлов на структуру белка
Металлы играют важную роль в формировании и стабилизации структуры белка. Они могут встраиваться в активные центры ферментов, влияя на их каталитическую активность. Также они могут связываться с определенными аминокислотами или кофакторами, изменяя конформацию белка.
Металлы могут быть как необходимыми для правильного складывания белка, так и вызывать его денатурацию. Их наличие или отсутствие может влиять на структуру и функцию белка.
Одним из примеров влияния металлов на структуру белка является гемоглобин — белок, который содержит железо в своей четвертичной структуре. Железо связывает кислород, позволяя гемоглобину выполнять свою основную функцию — транспорт кислорода по организму.
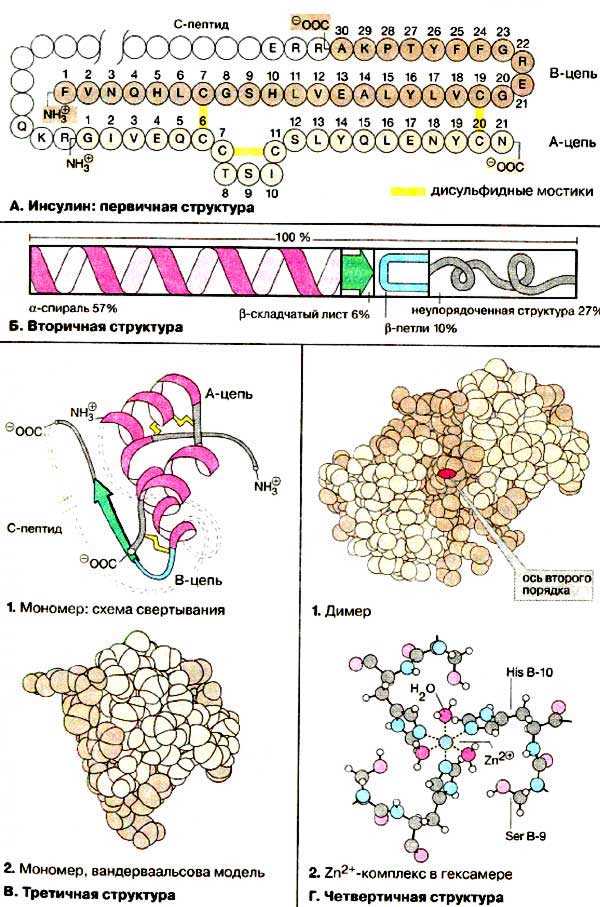
Еще одним примером является цинк, который играет важную роль в структуре молекулы инсулина. Он участвует в формировании связей между цепями аминокислот и помогает поддерживать устойчивую трехмерную структуру инсулина, что обеспечивает его активность.
Таким образом, металлы могут оказывать значительное влияние на структуру белка, определяя его функциональность и стабильность. Исследование взаимодействия металлов с белками является важной задачей в биохимии и может помочь в разработке новых лекарственных препаратов и технологий.
Функциональное значение четвертичной структуры
Четвертичная структура молекулы белка представляет собой сложную пространственную организацию, состоящую из нескольких подчастей. Эта структура играет важную роль в функционировании белка и определяет его способность выполнять свою функцию в организме.
Одной из основных функций четвертичной структуры является обеспечение стабильности и прочности молекулы белка. Взаимодействие между подчастями молекулы, связанными в четвертичную структуру, способствует ее устойчивости к внешним воздействиям, таким как изменения pH, температуры или наличие различных веществ в окружающей среде. Благодаря этому белки могут выполнять свои функции в различных условиях, поддерживая биологическую активность и стабильность организма.
Важной функцией четвертичной структуры также является формирование активного центра. Внутри этой структуры могут размещаться аминокислотные остатки, которые исполняют самые разнообразные функции: катализируют химические реакции, связываются с другими молекулами или сигнальными системами, обеспечивают конкретные физические или структурные свойства белка. Формирование активного центра позволяет белкам выполнять свои функции точно и специфически, и, следовательно, является ключевым аспектом их роли в организме.
Кроме того, четвертичная структура белка может управлять его взаимодействием с другими белками или молекулярными комплексами. Наличие специфических участков или поверхностей на подчастях молекулы может обеспечивать связывание с другими молекулами, что позволяет белкам участвовать в сложных биологических процессах, таких как передача сигналов, транспорт молекул или связывание с поверхностью клетки. Такие взаимодействия позволяют белкам выполнять разнообразные функции в организме и координировать работу клеток и тканей.
Интеракция между подчастями
Четвертичная структура молекулы белка достигается за счет взаимодействия между подчастями, обладающих комплементарной формой и зарядами. Типы взаимодействий, обеспечивающих стабильность и специфичность четвертичной структуры, включают гидрофобные взаимодействия, электростатические взаимодействия, водородные связи, сольватацию и межцепочечные дисульфидные связи.
Примеры белков с четвертичной структурой
- Инсулин — белок, состоящий из двух цепей, связанных между собой взаимодействием гидрофобных взаимодействий и сольватацией.
- Гемоглобин — белок, состоящий из четырех подчастей, связанных между собой взаимодействием водородных связей и гидрофобных взаимодействий. Такая структура обеспечивает его способность переносить кислород в крови.
- Иммуноглобулины — белки антитела, состоящие из двух подчастей, связанных между собой дисульфидными связями. Это обеспечивает специфичность взаимодействия с антигенами.
В целом, функциональное значение четвертичной структуры молекулы белка заключается в ее способности обеспечивать стабильность, формировать активный центр и регулировать взаимодействие с другими молекулами. Это позволяет белкам выполнять различные функции в организме и обеспечивает их участие в сложных биологических процессах.